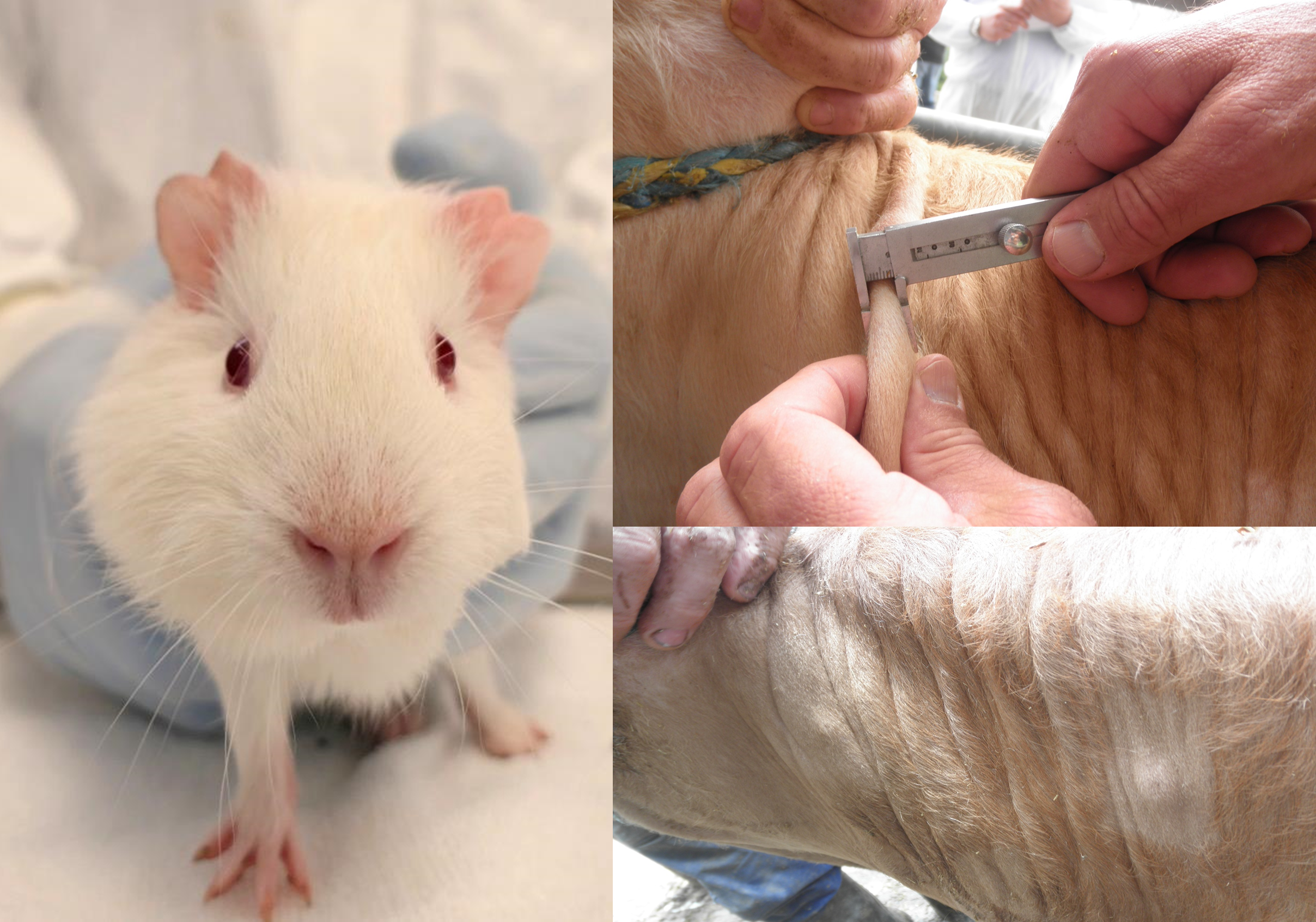
Continuando con el estudio de la teoría de la inmunidad innata entrenada que postula que la respuesta desencadenada por un patógeno primario protege más eficientemente en la exposición secundaria al mismo o a otros patógenos, el grupo de micobacterias del departamento de Sanidad Animal de NEIKER acaba de publicar un artículo en la revista Veterinary Research. En este artículo se examina el efecto de una vacuna de micobacterias en el control de la infección por Sarcoptes scabiei en conejo. La publicación se titula: “Non specific effects of inactivated Mycobacterium bovis oral and parenteral treatment in a rabbit scabies model” [Efectos no específicos del tratamiento oral y parenteral con Mycobacterium bovis inactivado en un modelo de sarna en conejo]. El trabajo dirigido por investigadores de NEIKER, está firmado también por investigadoras del SERIDA, la Universidad de León y el Instituto de Salud Carlos III. En el se examinan los efectos de la vacuna de M. bovis inactivado (HIMB) sobre la respuesta inmune humoral y celular periférica a lo largo del periodo experimental, así como de la evolución de las lesiones y la carga parasitaria final en animales vacunados y no vacunados por vía oral y subcutánea. La hipótesis de trabajo, inspirada en los efectos protectores no específicos de la vacunación contra tuberculosis en humanos y de la eficacia de la vacuna inactivada contra la paratuberculosis, era que la administración del antígeno desarrollado por NEIKER modificaría la respuesta al desafío experimental heterólogo en el modelo de sarna leporina desarrollado por el SERIDA.Veinticuatro conejos tratados oral o subcutáneamente con una suspensión de HIMB (10^7 UFC) o placebo fueron expuestos a una infestación reiterada por S. scabiei a los 84 días post-vacunación, seguidos mediante examen clínico, extracción de sangre cada 2 semanas y sacrificados a los 92 días post-infestación. Los sueros fueron sometidos a pruebas de ELISA casero frente al antígeno específico de tuberculosis p22, así como a la prueba de doble reconocimiento comercial y a un ELISA-SERIDA de sarna basado en la proteína Ssλ20∆B3. Además, se evaluaron los niveles de IFN-gamma basales.
Solamente se observó una respuesta específica frente a tuberculosis en los animales vacunados parenteralmente. Todos los animales desarrollaron respuesta humoral frente a antígenos de sarna y lesiones cutáneas características. Ambos grupos vacunados mostraron reducciones en la extensión de las lesiones de hasta 74% y 62% por vía subcutánea y oral, respectivamente. Las cargas de ácaros, sin embargo, aumentaron significativamente respecto al placebo en el grupo vacunado subcutáneamente (170%) y disminuyeron en el vacunado oralmente (39%). Estos efectos, así como las correlaciones entre la respuesta humoral frente a tuberculosis y la carga parasitaria (r=0.6276; p=0.0031) son evidencias de un efecto de inmunidad innata entrenada inducido por bacterias inactivadas de M. bovis. La vía de administración parece jugar un papel crítico en la inducción de una respuesta eficiente en términos parasitológicos y patológicos. Esto indica que la respuesta humoral contra tuberculosis inducida por la vía subcutánea podría resultar contraproducente en términos parasitológicos, mientras que su ausencia sería beneficiosa en relación con ambas variables. Es necesario seguir investigando en esta línea para afinar tanto en la vía de administración de la vacuna, como en la magnitud del desafío para ajustar las variables a la optimización de la protección patológica y epidemiológica. Una protección no-especifica de este tipo suficientemente eficiente podría ser clave para reducir el uso de antibióticos y antiparasitarios.