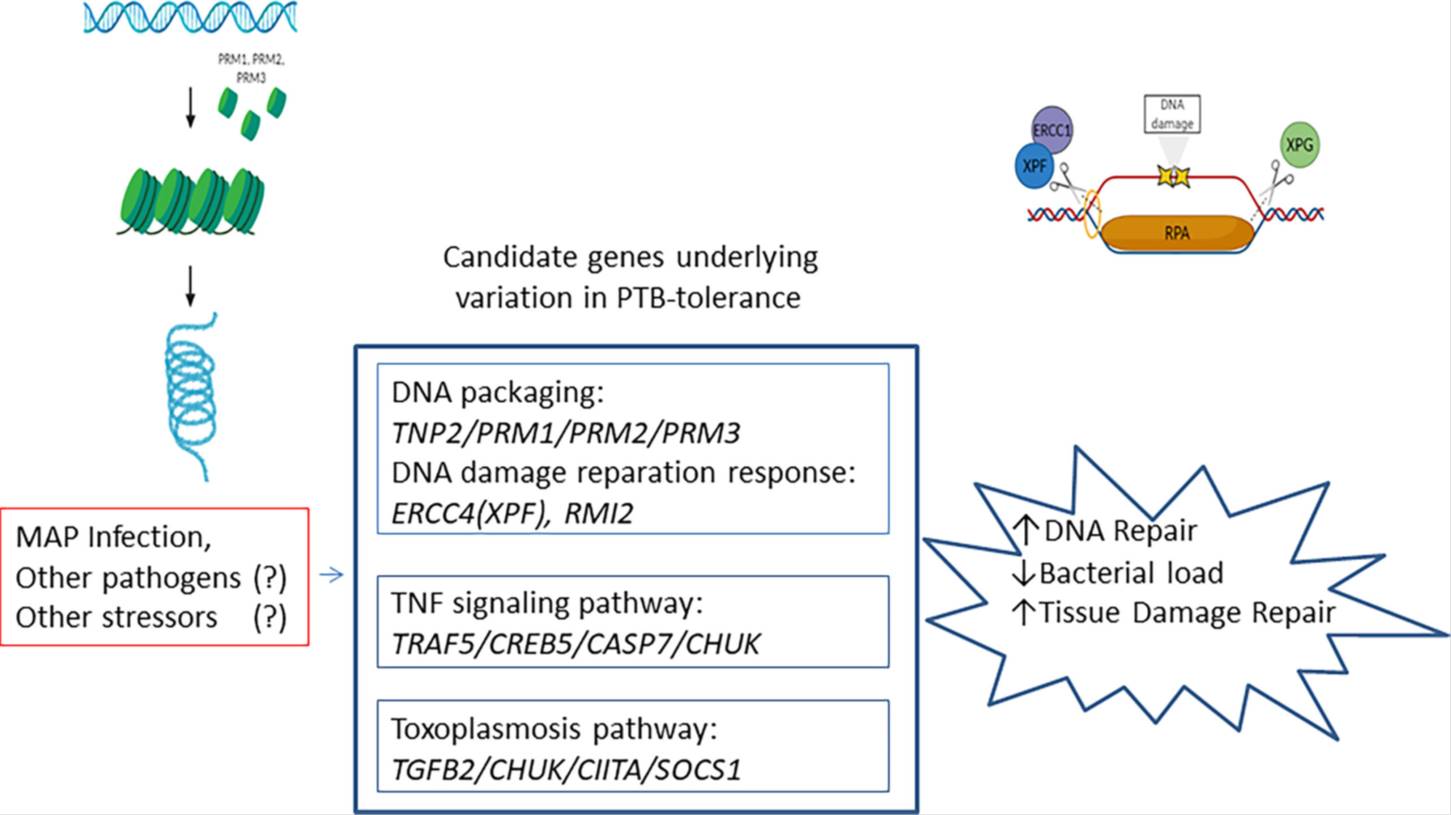
Mycobacterium avium subsp. paratuberculosis (MAP) es el agente causal de la paratuberculosis (PTB), una enteritis granulomatosa crónica que provoca grandes pérdidas económicas en el sector vacuno lechero. Aunque la susceptibilidad genética a la PTB ha sido ampliamente estudiada, hasta la fecha se desconocía si existían animales con un perfil genético determinado que les permitiese tolerar la enfermedad sin desarrollar lesiones. En el caso de las enfermedades como la PTB, endémicas y crónicas que dan lugar a un elevado número de animales asintomáticos, la selección de animales tolerantes podría ser una estrategia ventajosa para controlar la enfermedad porque evitaría el sacrificio y reemplazo de los animales que, aunque infectados, no desarrollan signos clínicos, ni lesiones. Comprender la base genética que controla la inflamación y el daño tisular es útil en el desarrollo de agentes moduladores e inductores de tolerancia y, permitiría afinar en la selección de animales con una mayor tolerancia a la PTB. Por otro lado, los mecanismos de tolerancia que reparan el daño ocasionado por la infección son comunes frente a una amplia gama de patógenos y, en última instancia, determinan la salud general del hospedador y su longevidad. Por ello, en el Departamento de Sanidad Animal de NEIKER nos propusimos determinar si existe una base genética asociada a la tolerancia a la PTB y de esta forma definir las regiones genéticas y los mecanismos celulares y moleculares responsables de esta. Para ello, se realizó un estudio de asociación a genoma completo (GWAS) de tipo caso-control utilizando los genotipos imputados a secuencia completa de vacas frisonas con resultado positivo en PCR y cultivo de tejidos, pero sin lesiones en tejido intestinal y linfonodos asociados (N= 24). Partiendo de esta definición de caso, la población control estaba representada por 253 vacas con resultado negativo en PCR y cultivo de tejidos y con lesiones focales. En total, se detectaron 40 polimorfismos de un solo nucleótido, 98 genes candidatos, 7 ontologías génicas y 2 rutas metabólicas asociadas a la tolerancia a la PTB. Las 7 ontologías génicas identificadas estaban relacionadas con el empaquetamiento y cambios conformacionales del DNA, mientras que las dos rutas enriquecidas se relacionaban con la inducción de respuesta inmune innata mediada por el factor de necrosis tumoral (TNF) y con la Toxoplasmosis. El daño del DNA puede comprometer la homeostasis del organismo y contribuir a la aparición de enfermedades. Por ello, los individuos con mayor capacidad para reparar y empaquetar el DNA correctamente presentan una mejor homeostasis celular y una mayor esperanza de vida. Por otro lado, la respuesta inmune innata, pese a ser importante para la eliminación del patógeno, también puede llegar a provocar daño tisular si no es controlada. En nuestro estudio, además de la ruta de señalización del TNF, identificamos un enriquecimiento de genes candidatos implicados en la ruta de la Toxoplasmosis en los animales tolerantes. La activación de esta ruta metabólica podría resultar en el establecimiento de una infección persistente por MAP tal y como se ha descrito en infecciones causadas por parásitos intracelulares que son capaces de persistir en el hospedador durante toda la vida. En resumen, nuestro estudio permitió definir un perfil inmunogenético específico en los animales tolerantes, diseñado para reparar daños en el DNA, controlar la carga bacteriana, modular la inflamación, limitar el daño tisular, y favorecer el establecimiento de una infección persistente.
Este trabajo se ha realizado en colaboración con el Departamento de Mejora Genética Animal del Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria, CSIC, ha sido posible gracias a un proyecto financiado por el Ministerio de Ciencia, Innovación y Universidades (RTI2018-094192-R-C21) y ha sido publicado en la revista de libre acceso Frontiers in Immunology: https://pubmed.ncbi.nlm.nih.gov/35464478/